Neun Monate nach Pandemiebeginn standen bereits erste Covid-19-Impfstoffe zur Verfügung: Bewohnerin eines Altersheims im Kanton Basel-Landschaft erhält Ende Dezember 2020 die erste Dosis. (Bild: Keystone)
Als Zulassungsbehörde für Arzneimittel in der Schweiz steht Swissmedic (siehe Kasten) seit Ausbruch der Covid-19-Pandemie im Rampenlicht. Einerseits wird gefordert, Impfstoffe und Therapeutika schnellstmöglich zuzulassen. Andererseits wird von der Heilmittelbehörde erwartet, dass sie die Sicherheit vor und nach dem Marktzutritt sorgfältig prüft und überwacht. Wie hat Swissmedic die Krise bisher erlebt, und welche ersten Lehren lassen sich daraus ableiten?
Dank gezielter Massnahmen nach den Erfahrungen während der H1N1-Virus-Pandemie («Schweinegrippe») 2009/2010 war Swissmedic für den Ernstfall gewappnet. Wir bauten die Zusammenarbeit und den Informationsaustausch mit unseren internationalen Partnern aus, erarbeiteten Prozesse für Zulassungsverfahren für Arzneimittel im Pandemiefall und waren dank hohem Digitalisierungsgrad der geschäftskritischen Anwendungen technisch für den Ausnahmezustand bereit. Als der Bundesrat im März 2020 die Bevölkerung auf einen «Marathon» einschwor, hatte die Arbeitsgruppe «Pandemie» gemäss dem internen Pandemieplan ihre Tätigkeit bereits aufgenommen. Sie stellte unter anderem die auf die Krise zugeschnittene Führung der Organisation nach innen sowie mit Massnahmen (zum Beispiel Homeoffice) und wöchentlichen Informationen den Schutz der Mitarbeitenden sicher.
Zusätzlich stellte die ebenfalls eigens zur Pandemiebewältigung geschaffene Swissmedic-Covid-19-Taskforce den Informationsaustausch mit nationalen Gremien sicher, präzisierte die konkrete Umsetzung der bestehenden Zulassungsverfahren für Covid-19-Arzneimittel im Pandemiefall und unterstützte die Kommunikation mit der Öffentlichkeit. Unsere Mitarbeitenden beteiligten sich an der wissenschaftlichen Prüfung potenziell erfolgreicher Impfstoffkandidaten oder berieten Gremien der Logistik bei Beschaffungsfragen. So konnten wir unseren Beitrag bei der Vorbereitung und Umsetzung der Corona-Massnahmen auf Stufe Bund und in Richtung der Kantone leisten.
Bei der Kommunikation mit Politik und Zivilgesellschaft in der Schweiz war das Ziel, transparent und laienverständlich grösstmögliches Vertrauen in die neu zugelassenen Impfstoffe zu schaffen: Bereits Wochen vor der ersten Zulassung der Covid-19-Impfstoffe im Dezember 2020 erklärten wir mit einfach verständlichen Videos die Technologien und die Funktionsweise der Impfstoffe. Dabei kommunizierten wir auch erstmals verstärkt über Social-Media-Kanäle, um möglichst breite Bevölkerungskreise zu erreichen und um «Fake News» entgegenzuwirken.
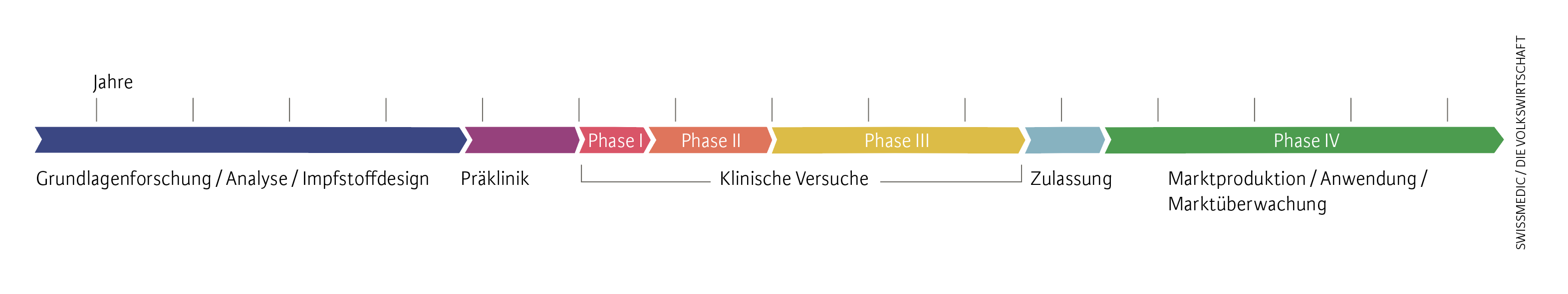
Normalerweise vergehen Jahre
Anfang März 2020 hätte kaum jemand gedacht, dass neun Monate später bereits erste Impfstoffe bereitstehen würden. Normalerweise vergehen mehrere Jahre, bis vielversprechende neue aktive Substanzen identifiziert und ausreichend geprüft sind – nur wenige Substanzen schaffen es bis zum fertigen Arzneimittel (siehe Abbildungen).
Abb. 1. Standard-Impfstoffentwicklung
Abb. 2: Marktzutritt von Covid-19-Impfstoffen

Vor Beginn klinischer Versuche am Menschen werden Wirkstoffkandidaten in Simulationen, im Labor und in präklinischen Tierversuchen getestet. In der klinischen Phase I wird ein Präparat erstmals wenigen freiwilligen, gesunden Probanden verabreicht, um Körperreaktion, Stoffwechsel und Verträglichkeit zu prüfen. Die Phase II mit Dutzenden bis ein paar Hundert Patienten liefert weitere Erkenntnisse zur Sicherheit, zur Wirksamkeit und zur optimalen Dosierung.
In den Zulassungsstudien der Phase III wird abschliessend an Hunderten bis Tausenden Teilnehmern das Nebenwirkungsprofil ermittelt, um zu klären, in welcher Bevölkerungs- und Patientengruppe der erwartete Nutzen grösser ist als potenzielle Risiken. Erst wenn statistisch aussagekräftige Schlussfolgerungen eine Nutzen-Risiko-Beurteilung erlauben, kann ein neues Präparat bei den Heilmittelbehörden zur Zulassung angemeldet werden. Dabei müssen die Gesuchsteller auch darlegen, wie sie nach der breiten Anwendung eines Arzneimittels das Sicherheitsprofil weiterverfolgen (Phase IV).
Nicht bei null begonnen
Wie war die Erstzulassung eines neuartigen Covid-19-Impfstoffs im Rahmen eines ordentlichen Verfahrens am 19. Dezember 2020 in der Schweiz möglich? Mehrere Faktoren, die unter dem Druck der Erwartungen zusätzlich kombiniert wurden, spielten zusammen. Die forschende Industrie konnte auf jahrzehntelange Grundlagenforschung an der mRNA-Technologie zurückgreifen. Zum Stachelprotein (Antigen) der Coronaviren lagen Erkenntnisse aus der Impfstoffforschung früherer Epidemien (Sars 2003/2003 und Mers 2012) vor. Die Gensequenzierung von Viren kann heute im Gegensatz zu früher in wenigen Tagen durchgeführt werden. Forschungsresultate wurden uneigennützig geteilt und waren schnell öffentlich zugänglich. Die Entwicklungskosten – normalerweise ein limitierender Faktor – spielten keine Rolle.
Weiter erleichterte der Pandemieverlauf die klinische Erprobung der Impfstoffe. Weltweit konnten in Rekordzeit genügend Freiwillige für die Studien rekrutiert werden. Die klinischen Studien der verschiedenen Phasen wurden ausserdem überlappend beziehungsweise parallel durchgeführt.
Auch bei Swissmedic drückten wir aufs Gaspedal: Früh setzten wir uns mit Pharmafirmen und Forschergruppen in Verbindung und führten wissenschaftliche und regulatorische Beratungsgespräche. Gleichzeitig vereinbarten wir mit unseren weltweiten Partnerbehörden grundlegende Anforderungen zur Entwicklung und Zulassung von Covid-19-Impfstoffen, etwa im Rahmen der International Coalition of Medicines Regulatory Authorities (ICMRA).
Ausserdem etablierten wir in der Pandemie die «Rolling Submission», um den Begutachtungsprozess maximal zu beschleunigen: Bei diesem Verfahren der schrittweisen Einreichung müssen die Gesuchsteller kein vollständiges Dossier vorlegen. Stattdessen prüfen die Zulassungsbehörden die eingehenden Datenpakete laufend – sobald zum Beispiel neue Resultate aus klinischen Studien vorliegen. Kombiniert mit der im Schweizer Heilmittelgesetz definierten befristeten Zulassung – einem ordentlichen Zulassungsverfahren und keiner Notfallzulassung –, konnten Entscheide ausserordentlich rasch gefällt werden, ohne auf die gründliche Prüfung von Sicherheit, Wirksamkeit und Qualität der Impfstoffe zu verzichten.
Nach der Pandemie ist vor der Pandemie
Welche Erkenntnisse lassen sich aus den bisherigen Erfahrungen während der Pandemie für Swissmedic ableiten? Ein vorbereiteter Pandemieplan, das sowohl national als auch international tragfähige Netzwerk mit etablierten Kommunikationskanälen und ein hoher Digitalisierungsgrad waren entscheidend, damit Swissmedic als systemrelevante Organisation der öffentlichen Gesundheit jederzeit handlungsfähig blieb. So konnten wir trotz hoher Belastung unseren gesetzlichen Auftrag in Bezug auf Zulassung und Marktüberwachung auch der anderen Arzneimittel jederzeit erfüllen. Die Krisenbewältigung verlangte zusätzlich eine klare Führung sowie eine flexible und situationsgerechte Planung. In der Kommunikation schaffte Transparenz Vertrauen und vermittelte Sicherheit. Zudem zeigte sich, wie wichtig fortschreitende Digitalisierung und innovative Lösungen sind.
Die Kombination der geschilderten Faktoren, ergänzt mit Forscherglück und gegenseitiger Hilfsbereitschaft, trugen zur beispiellos kurzen Markteinführung von hochwirksamen und sicheren Impfstoffen bei. Die Zulassung der Covid-19-Impfstoffe ist ein Erfolgsmodell zum Nutzen der Patientinnen und Patienten, welches auch in Zukunft gelebt werden sollte.
Zitiervorschlag: Raimund Bruhin (2021). Swissmedic drückte bei Corona-Impfstoffen aufs Gaspedal. Die Volkswirtschaft, 29. November.
Medikamente müssen qualitativ hochstehend, sicher und wirksam sein. Dafür sorgt das Schweizerische Heilmittelinstitut Swissmedic, die schweizerische Zulassungs- und Aufsichtsbehörde für Heilmittel (Arzneimittel und Medizinprodukte). Das Institut ist dem Eidgenössischen Departement des Innern angegliedert, in seiner Organisation und Betriebsführung selbstständig und verfügt über ein eigenes Budget.
Das könnte Sie auch interessieren

Schweizerische Eidgenossenschaft
Confédération suisse
Confederazione Svizzera
Confederaziun svizra
Eidgenössisches Departement für
Wirtschaft, Bildung und Forschung WBF
Staatssekretariat für Wirtschaft SECO